
Oltre alle spesso discusse mutazioni del gene BRCA, esiste un numero significativo di altro mutazioni genetiche ereditarie che aumentano il rischio di sviluppare il cancro al seno. In effetti, si ritiene che le mutazioni in oltre 100 geni contribuiscano al rischio e si prevede che il numero di mutazioni del gene non BRCA che aumentano il rischio di cancro al seno aumenterà con l'aumentare della nostra conoscenza della genetica del cancro.
Oltre alle mutazioni dei geni BRCA1 e BRCA2, alcune di queste includono mutazioni in ATM, PALB2, PTEN, CDH1, CHEK2, TP53, STK11, PMS2 e altri. Diamo un'occhiata all'importanza di queste mutazioni non BRCA1/BRCA2 nel carcinoma mammario familiare e ad alcune delle caratteristiche di quelle che si trovano più comunemente.
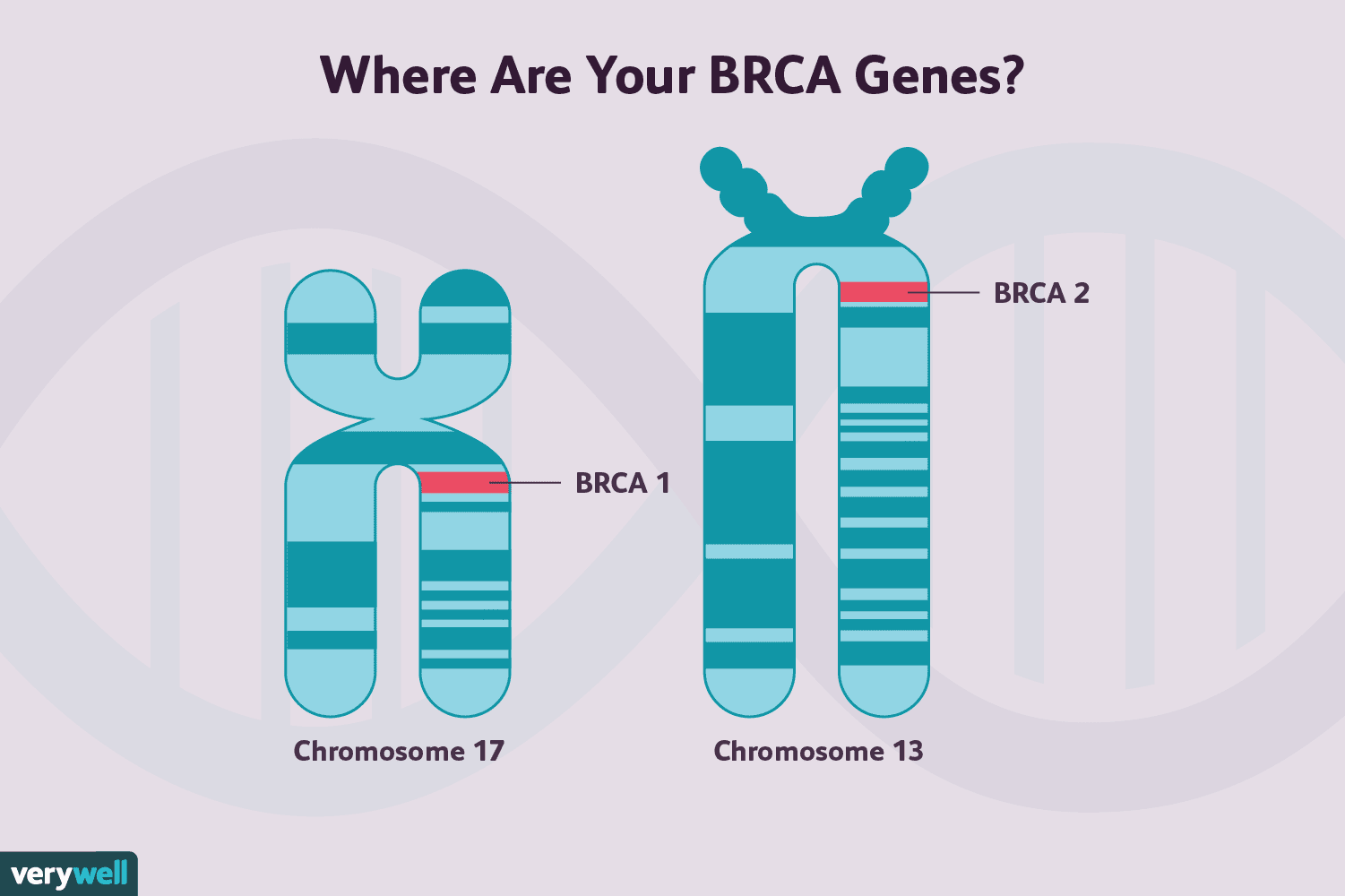
Attualmente si ritiene che dal 5% al 10% dei tumori al seno siano genetici o familiari ( sebbene questo numero possa cambiare man mano che impariamo di più), ma non tutti questi tumori sono dovuti a mutazioni BRCA.
Al massimo, il 29% (e probabilmente molto meno) dei tumori al seno ereditari risulta positivo per le mutazioni del gene BRCA1 o BRCA2 e molte persone stanno effettuando test per gli altri cambiamenti genetici noti.
Dato che la scienza alla base del cancro ereditario è molto ansiosa, per non dire confusa e incompleto, è utile iniziare parlando della biologia delle mutazioni genetiche e di come questi cambiamenti nel DNA svolgano un ruolo nello sviluppo del cancro.
Quando si parla di mutazioni, è importante distinguere tra mutazioni genetiche ereditarie e acquisite.
Le mutazioni genetiche acquisite o somatiche hanno ricevuto molta attenzione negli ultimi anni, poiché queste le mutazioni causano cambiamenti che guidano la crescita del cancro. Le terapie mirate, i farmaci che prendono di mira specifici percorsi correlati a questi cambiamenti, hanno migliorato significativamente il trattamento di alcuni tipi di cancro come quello del polmone.
Le mutazioni acquisite, invece, non sono presenti dalla nascita, ma si formano tempo dopo la nascita nel processo in cui una cellula diventa una cellula cancerosa. Queste mutazioni colpiscono solo alcune cellule del corpo. Non sono ereditati da un genitore, ma piuttosto "acquisiti" in quanto il DNA nelle cellule è esposto ai danni dell'ambiente o come risultato dei normali processi metabolici dell'organismo.
Le mutazioni ereditarie o della linea germinale, al contrario, sono cambiamenti genetici che le persone sono nati con, e che sono stati tramandati da uno o entrambi i genitori. Queste mutazioni colpiscono tutte le cellule del corpo. Sono queste mutazioni ereditarie (e altri cambiamenti genetici) che possono aumentare la possibilità che una persona sviluppi il cancro e spiegare quello che è noto come cancro al seno ereditario o familiare.
Mutazioni genetiche ereditarie (germinali) vs. acquisite (somatiche).Molte persone si chiedono come esattamente un gene anomalo o combinazioni di geni possano portare al cancro al seno e una breve discussione sulla biologia è utile per comprendere molte delle domande, ad esempio perché non tutti coloro che hanno queste mutazioni sviluppano il cancro.
Il nostro DNA è un modello o codice utilizzato per produrre proteine. Quando la mappa o il codice sono sbagliati (come il "carattere" in un particolare gene), fornisce le indicazioni sbagliate per sintetizzare una proteina. La proteina anormale non è quindi in grado di svolgere il suo solito lavoro. Non tutte le mutazioni genetiche aumentano il rischio di cancro e, in effetti, la maggior parte non lo fa. Le mutazioni nei geni responsabili della crescita e della divisione delle cellule, o "mutazioni del driver", sono ciò che guida la crescita dei tumori. Esistono due tipi principali di geni che, quando mutati, possono portare a una crescita incontrollata nota come cancro:gli oncogeni e i geni oncosoppressori.
Molti dei geni associati a un rischio più elevato di cancro al seno sono geni oncosoppressori. Questi geni codificano per proteine che funzionano per riparare i danni al DNA nelle cellule (danni causati dalle tossine nell'ambiente o dai normali processi metabolici nelle cellule), servono per eliminare le cellule che non possono essere riparate o regolano la crescita in altri modi. I geni BRCA1 e BRCA2 sono geni oncosoppressori.
Molti di questi geni sono autosomici recessivi, il che significa che ogni persona eredita una copia del gene gene di ciascun genitore ed entrambe le copie devono essere mutate per aumentare il rischio di cancro. Semplificando, ciò significa che una combinazione di fattori genetici e ambientali (una mutazione acquisita nell'altro gene) deve agire insieme per provocare lo sviluppo del cancro. In aggiunta a questo, di solito, devono verificarsi diverse mutazioni affinché una cellula diventi una cellula cancerosa.
Cosa significa avere una predisposizione genetica al cancroNon tutte le mutazioni geniche o i cambiamenti genetici aumentano il rischio di cancro al seno nella stessa misura , e questo è un concetto importante per chiunque stia considerando i test genetici, soprattutto perché molte persone hanno sentito parlare dell'altissimo rischio conferito dalle mutazioni BRCA. La penetranza genica è definita come la proporzione di persone con una mutazione che sperimenteranno la condizione (in questo caso, svilupperanno il cancro al seno).
Per alcune mutazioni, il rischio di cancro al seno è molto alto. Per altri, il rischio può essere aumentato solo di un fattore 1,5. Questo è importante da capire quando si parla di possibili opzioni preventive.
Un altro concetto importante che è importante per comprendere la genetica e il cancro, anche se troppo complesso per essere esplorato in dettaglio qui, è quella dell'epigenetica. Abbiamo appreso che i cambiamenti nel DNA che non implicano cambiamenti nelle coppie di basi (nucleotidi) o nelle "lettere" che codificano per una proteina, possono essere altrettanto importanti nello sviluppo del cancro. In altre parole, invece di cambiamenti strutturali nella spina dorsale del DNA, possono esserci cambiamenti molecolari che cambiano il modo in cui il messaggio viene letto o espresso.
Le mutazioni del gene BRCA sono l'anomalia genetica più nota associata al cancro al seno, ma è stato chiaro che ci sono donne predisposte al cancro al seno in base alla loro storia familiare, che risultano negative al test.
Uno studio del 2017 ha rilevato che le mutazioni BRCA rappresentavano solo dal 9% al 29% delle mutazioni ereditarie tumori al seno. Anche quando è stato eseguito il test per altre 20-40 mutazioni note, tuttavia, solo dal 4% all'11% delle donne è risultato positivo. In altre parole, dal 64% all'86% delle donne sospettate di avere un cancro al seno ereditario è risultato negativo sia per le mutazioni BRCA che per altre 20-40.
Le nostre conoscenze sulle mutazioni genetiche che aumentano il rischio di cancro al seno sono ancora incomplete, ma ora sapere che ci sono almeno 72 mutazioni genetiche legate al cancro al seno ereditario. Si ritiene che queste mutazioni (e altre ancora sconosciute) siano responsabili dal 70% al 90% dei tumori al seno ereditari che risultano negativi alle mutazioni del gene BRCA. L'acronimo BRCAX è stato coniato per descrivere queste altre mutazioni, che stanno per carcinoma mammario familiare non correlato a BRCA1 o BRCA2.
72 mutazioni genetiche legate al cancro al seno ereditarioLe anomalie genetiche seguenti differiscono nella loro frequenza, la quantità di rischio associato, il tipo di cancro al seno a cui sono collegati e altri tumori associati alle mutazioni.
La maggior parte di questi tumori al seno hanno caratteristiche simili (come tipo di cancro, estrogeni- stato del recettore e stato HER2) a tumori mammari non ereditari o sporadici, ma ci sono delle eccezioni. Ad esempio, alcune mutazioni sono più fortemente associate al carcinoma mammario triplo negativo, comprese le mutazioni in BARD1 , BRCA1 , BRCA2 , PALB2 e RAD51D .
Non tutte le persone che hanno le seguenti mutazioni genetiche sono uguali. In generale, ci possono essere centinaia di modi in cui questi geni vengono mutati. In alcuni casi, il gene produrrà proteine che sopprimono la crescita del tumore, ma le proteine non funzioneranno bene come la proteina normale. Con altre mutazioni, la proteina potrebbe non essere prodotta affatto.
Le mutazioni del gene BRCA 1 e quelle del gene BRCA2 sono entrambe associate ad un aumentato rischio di sviluppo cancro al seno, così come alcuni altri tipi di cancro, anche se i due differiscono in qualche modo in questo rischio.
In media, il 72% delle donne che hanno mutazioni BRCA1 e il 69% che hanno i geni BRCA2 mutati svilupperanno il cancro al seno all'età di 80 anni.
Inoltre, i tumori al seno associati a queste mutazioni possono differire. I tumori al seno nelle donne che hanno mutazioni BRCA1 hanno maggiori probabilità di essere triplo negativo. Circa il 75% è negativo al recettore degli estrogeni e ha anche meno probabilità di essere HER2 positivo. Hanno anche maggiori probabilità di avere un grado di tumore più elevato. I tumori al seno nelle donne con mutazioni BRCA2, al contrario, sono simili ai tumori nelle donne che non sono portatrici della mutazione del gene BRCA.
Il gene ATM codifica per proteine che aiutano a controllare il tasso di crescita delle cellule. Aiutano anche nella riparazione delle cellule danneggiate (cellule che hanno subito danni al DNA dalle tossine) attivando enzimi che riparano questo danno.
Coloro che hanno due copie del gene mutato hanno una sindrome autosomica recessiva non comune nota come atassia-telangectasia. Con l'atassia-telangectasia, le proteine difettose non solo aumentano il rischio di cancro, ma provocano la morte troppo rapida di alcune cellule del cervello, provocando un disturbo neurodegenerativo progressivo.
Le persone che hanno una sola copia mutata del gene (circa l'1% della popolazione) hanno un rischio nel corso della vita dal 20% al 60% di sviluppare il cancro al seno.
Si ritiene che le persone che hanno questa mutazione siano predisposte al cancro al seno in tenera età , nonché allo sviluppo di cancro al seno bilaterale.
Lo screening del cancro al seno con risonanza magnetica mammaria è raccomandato a partire dai 40 anni e le donne potrebbero desiderare considerare le mastectomie preventive. Le persone con un gene ATM mutato sembrano anche essere predisposte ai tumori della tiroide e del pancreas e sono più sensibili alle radiazioni.
Anche le mutazioni nel gene PALB2 sono un'importante causa di cancro al seno ereditario. Il gene PALB2 codifica per una proteina che funziona in combinazione con la proteina BRCA2 per riparare il DNA danneggiato nelle cellule. Nel complesso, il rischio per tutta la vita di cancro al seno con una mutazione PALB2 raggiunge il 58%, sebbene questo possa variare in base all'età. Il rischio è da 8 volte a 9 volte la media per le donne di età inferiore ai 40 anni, ma circa 5 volte la media per le donne di età superiore ai 60 anni.
Tra coloro che portano una copia del gene, il 14% svilupperà il cancro al seno all'età di 50 anni e il 35% all'età di 70 anni (meno che con le mutazioni BRCA).
Le persone che hanno una mutazione PALB2 e sviluppano un cancro al seno possono avere un rischio maggiore di morire dalla malattia.
Le persone che ereditano 2 copie del gene PALB2 mutato hanno un tipo di anemia di Fanconi caratterizzata da una conta molto bassa di globuli rossi, globuli bianchi e piastrine.
Il gene CHEK2 codifica per una proteina che si attiva quando si verifica un danno al DNA. Attiva anche altri geni coinvolti nella riparazione cellulare.
I rischi per tutta la vita per i portatori di mutazioni troncanti CHEK2 sono del 20% per una donna senza parente affetto, 28% per una donna con un parente di secondo grado affetto, 34% per una donna con un parente di primo grado affetto e 44% per una donna con un parente di primo e secondo grado affetti.
Per uomini e donne, il gene aumenta anche il rischio di cancro al colon e non -Linfoma di Hodgkin.
Le mutazioni in CDH1 causano una condizione nota come sindrome del cancro gastrico ereditario.
Le persone che ereditano questo gene hanno un rischio per tutta la vita fino all'80% di sviluppare il cancro allo stomaco e fino al 52% di sviluppare il cancro al seno lobulare.
Il gene codifica per una proteina (caderina epiteliale) che aiuta le cellule ad attaccarsi l'una all'altra (una delle differenze tra le cellule tumorali e le cellule normali è che le cellule tumorali mancano di queste sostanze chimiche di adesione che le fanno aderire). I tumori nelle persone che ereditano questa mutazione hanno maggiori probabilità di metastatizzare.
Le mutazioni nel gene PTEN sono una delle mutazioni del gene oncosoppressore più comuni. Il gene codifica per le proteine che regolano la crescita delle cellule e aiuta anche le cellule a restare unite.
Le mutazioni nel gene sembrano aumentare il rischio di rottura delle cellule tumorali da un tumore e metastatizzazione. Il PTEN è associato a una sindrome chiamata sindrome da amartoma tumorale PTEN e sindrome di Cowden.
Le donne che portano una mutazione PTEN hanno un rischio per tutta la vita di sviluppare il cancro al seno fino all'85% e hanno anche un aumentato rischio di alterazioni benigne della mammella come malattie fibrocistiche, adenosi e papillomatosi intraduttale.
Le mutazioni sono anche collegate ad un aumentato rischio di cancro uterino (e fibromi uterini benigni ), cancro alla tiroide, cancro al colon, melanoma e cancro alla prostata.
I sintomi non correlati al cancro includono grandi dimensioni della testa (macrocefalia) e tendenza a formarsi tumori benigni noti come amartomi.
Le mutazioni in STK11 sono associate a una condizione genetica nota come sindrome di Peutz-Jegher. STK11 è un gene oncosoppressore coinvolto nella crescita cellulare.
Oltre a un aumentato rischio di cancro al seno (con un rischio per tutta la vita fino al 50%), la sindrome comporta un aumento del rischio di molti tumori, alcuni dei quali includono il cancro del colon, il cancro del pancreas, il cancro dello stomaco, il cancro delle ovaie, il cancro del polmone, cancro uterino e altro ancora.
Le condizioni non correlate al cancro associate alla mutazione includono polipi non cancerosi nel tratto digestivo e sistema urinario, lentiggini sul viso e all'interno della bocca e altro ancora. Lo screening del cancro al seno è spesso raccomandato per le donne che iniziano a 20 anni, e spesso con risonanza magnetica con o senza mammografie.
Il gene TP53 codifica per proteine che bloccano la crescita delle cellule anormali.
Queste mutazioni sono estremamente comuni nel cancro, con acquisite mutazioni nel gene p53 riscontrate in circa il 50% dei tumori.
Le mutazioni ereditarie sono meno comuni e associate a condizioni note come sindrome di Li-Fraumeni o Sindrome tipo Li-Fraumeni (che ha un minor rischio di cancro). La maggior parte delle persone che ereditano la mutazione sviluppa il cancro all'età di 60 anni e, oltre al cancro al seno, è incline a sviluppare cancro alle ossa, cancro del surrene, cancro del pancreas, cancro del colon, cancro del fegato, tumori del cervello, leucemia e altro ancora. Non è raro che le persone con la mutazione sviluppino più di un cancro primario.
Si ritiene che le mutazioni ereditarie nel gene p53 rappresentino circa l'1% dei casi di cancro al seno ereditario. I tumori al seno associati alla mutazione sono spesso HER2 positivi e hanno un grado tumorale elevato.
La sindrome di Lynch o il cancro colorettale ereditario non poliposico è associato a mutazioni in diversi geni inclusi PMS2, MLH1, MSH2, MSH6 ed EPCAM.
La PMS2, in particolare, è stata associata al doppio del rischio di cancro al seno. Il gene funziona come un gene oncosoppressore, codificando per una proteina che ripara il DNA danneggiato.
Oltre al cancro al seno, queste mutazioni comportano un alto rischio di cancro al colon , ovaio, utero, stomaco, fegato, cistifellea, intestino tenue, rene e cervello.
Ci sono molte altre mutazioni genetiche associate a un aumentato rischio di sviluppare il cancro al seno e si prevede che ne verranno scoperti altri nel prossimo futuro. Alcuni di questi includono:
Al momento, sono disponibili test per le mutazioni del gene BRCA e per le mutazioni ATM, CDH1, CHEK2, MRE11A, MSH6, NBN, PALB2, PMS2, PTEN, RAD50, RAD51C, SEC23B e TP53, con quest'area che dovrebbe espandersi notevolmente nel prossimo futuro.
La disponibilità di questi test, tuttavia, solleva molte domande. Ad esempio, chi potrebbe avere un cancro al seno ereditario e chi dovrebbe essere testato? Cosa dovresti fare se risulti positivo per uno di questi geni?
Idealmente, qualsiasi test dovrebbe essere eseguito solo con la guida e l'aiuto di un consulente genetico . Ci sono due ragioni per questo.
Uno è che può essere devastante apprendere che sei portatore di una mutazione che potrebbe aumentare il tuo rischio e la guida di qualcuno che è a conoscenza della gestione e dello screening consigliati è inestimabile.
Come notato in precedenza, alcune mutazioni conferiscono un rischio elevato e altre un rischio molto inferiore. Alcune mutazioni potrebbero essere più preoccupanti all'inizio della vita (diciamo, a 20 anni), mentre altre potrebbero non richiedere uno screening precoce. Un consulente genetico può aiutarti a conoscere ciò che è attualmente raccomandato per quanto riguarda lo screening per la tua particolare mutazione, tenendo conto di eventuali altri fattori di rischio che potresti avere.
L'altro motivo per cui la consulenza genetica è così importante è che potresti avere un rischio significativo di sviluppare il cancro al seno anche se i test sono negativi. C'è ancora molto da imparare e un consulente genetico può aiutarti a esaminare la tua storia familiare per vedere se potresti correre un rischio elevato nonostante il test negativo e pianificare lo screening di conseguenza.
Test genetici per il cancro al senoProprio come le persone a cui è stato diagnosticato un cancro al seno hanno bisogno di supporto, quelle che portano i geni che aumentano il rischio hanno bisogno di supporto. Fortunatamente, ci sono organizzazioni che si concentrano specificamente sul sostegno alle persone in questa situazione.
Un'organizzazione, FORCE, acronimo di Facing Our Risk of Cancer Empowered, offre una linea di assistenza, una bacheca e informazioni per coloro che stanno affrontando un cancro ereditario.
Altre organizzazioni e comunità di supporto sono disponibili per aiutare le persone a far fronte alle decisioni relative a un diagnosi di carcinoma mammario ereditario.
Il termine "previvor" è stato coniato dalla FORCE per descrivere le persone che sopravvivono a una predisposizione al cancro al seno. Se questa è la situazione che stai affrontando, non sei solo e, utilizzando l'hashtag #previvor, puoi trovarne molti altri su Twitter e altri social media.
Può essere travolgente conoscere le diverse mutazioni genetiche che aumentano il rischio di cancro al seno al di là delle mutazioni BRCA, ma queste "altre" mutazioni sono di importanza significativa sapendo che le mutazioni BRCA rappresentano una relativa minoranza di tumori al seno familiari. Allo stesso tempo, la scienza che esamina il cancro al seno ereditario è ancora agli inizi e c'è molto da imparare. Se sei preoccupato di avere una mutazione o di aver imparato che lo fai, è utile imparare il più possibile. Le organizzazioni per il cancro ereditario come FORCE non solo possono fornirti ulteriori informazioni, ma possono aiutarti a entrare in contatto con altre persone che stanno affrontando un viaggio con domande e preoccupazioni simili.